Aprueban inmunoterapia subcutánea contra el cáncer
 SOFIA ZANOTTI
SOFIA ZANOTTILa Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó en los primeros días de febrero la formulación subcutánea de nivolumab, una inmunoterapia anti PD-1 utilizada en distintos tumores sólidos. La decisión marca un paso relevante en la actualización de los tratamientos oncológicos en el país.

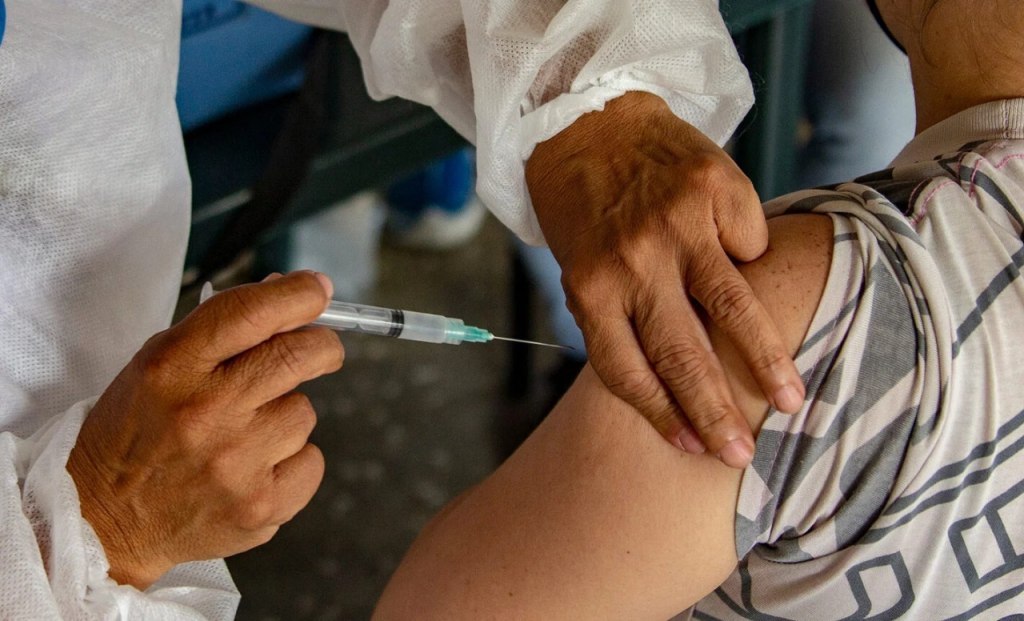
A diferencia de la vía endovenosa tradicional, que requiere entre 30 y 60 minutos de infusión y el uso de catéteres, la modalidad subcutánea se aplica bajo la piel en apenas tres a cinco minutos. Esto simplifica el procedimiento, reduce el tiempo en el hospital de día y mejora la experiencia del paciente.
La inmunoterapia actúa estimulando el sistema inmunológico para que reconozca y ataque las células tumorales. En este caso, el fármaco nivolumab mantiene las mismas indicaciones que su versión intravenosa: cáncer de pulmón de células no pequeñas, melanoma, carcinoma renal, tumores de cabeza y cuello, cáncer gástrico y esofágico, colorrectal con inestabilidad microsatelital alta, linfoma de Hodgkin clásico y cáncer de vejiga avanzado, entre otros.
Desde el Instituto Alexander Fleming, la oncóloga Ana Laura Mendaña explicó que la eficacia es equivalente a la formulación endovenosa. Según detalló, los estudios clínicos demostraron resultados comparables en términos de seguridad y efectividad, por lo que el cambio radica exclusivamente en la forma de administración.
En la misma línea, especialistas del Instituto de Oncología Ángel H. Roffo señalaron que esta modalidad favorece la adherencia al tratamiento y puede optimizar recursos hospitalarios. Menos tiempo en sillones de infusión implica mayor disponibilidad para otros pacientes y una logística más eficiente.
A nivel internacional, la tendencia apunta a desarrollar más inmunoterapias en formato subcutáneo. Incluso otros fármacos como el pembrolizumab avanzan hacia esquemas similares. En el Reino Unido, experiencias preliminares indicaron que este sistema podría liberar cientos de horas mensuales en atención sanitaria combinada.
En cuanto al acceso en Argentina, la situación no es homogénea. Aunque la aprobación regulatoria habilita su uso en el sistema público y privado, especialistas advierten que la incorporación efectiva puede demorar, especialmente en hospitales públicos. La formulación endovenosa, en cambio, ya se encuentra disponible de manera más extendida.
El estudio internacional de fase III que respaldó esta aprobación incluyó a 495 pacientes, con una participación destacada de centros argentinos. De ese total, 167 fueron tratados en ocho instituciones del país, lo que posiciona a la Argentina como parte activa en la investigación clínica global.
La innovación, coinciden los especialistas, no solo representa un avance terapéutico, sino también un cambio en la calidad de vida de quienes atraviesan tratamientos prolongados contra el cáncer.